推荐产品
公司新闻/正文
类器官相关-2025
148 人阅读发布时间:2025-01-02 21:13
肿瘤模型
肿瘤机制
肿瘤机制:亲代肿瘤的基因组、转录组、蛋白质组等多组学特征,细胞系模型所缺乏的异质性
临床前模型
肿瘤类器官;精准治疗;类器官生物样本库
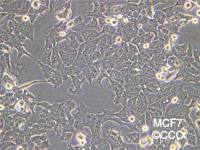
肿瘤细胞系( patient⁃derived tumourcell lines,PDCs)
患者来源肿瘤异种移植瘤(patient⁃derived tumour xenografts,PDXs)
类器官模型( patient⁃derived organoids,PDOs)
患者来源的肿瘤类器官(pa⁃tient⁃derived tumor organoids, PDTOs)
酶水解的方式可能会导致细胞间的相互作用减弱甚至消失,酶解离方式相比 机械切割法保留了组织和肿瘤微环境中细胞成分的天然结构,从而调节类器官的形成和表型。 但这种方法的缺点在于机械切割所产生的组织碎片会使被包裹细胞的胞外环境不均匀,包括不均匀的氧浓度和营养梯度。 钝性的组织切割也会损害肿瘤样本,使得最后所得的活细胞数量减少
配套品各厂家分析,研发生产提前技术储备
基底膜提取物( basement membrane ex⁃tracts,BME)将其包裹,并接种于孔板内形成穹顶样BME 是从小鼠Engelbreth⁃Holm⁃Swarm(EHS)肉瘤细胞中纯化出来
的一种可溶性基底膜,类 似 的 物 质 还 包 括 Matrigel 和 水 凝胶[6]常见的因子包括 Wnt 通路激动剂( Wnt⁃3a、R⁃Spondin 1),TGFβ 通路抑制剂(A83⁃01、Noggin),MAPK 通路抑制剂(SB202190)以及生长因子等---有兴趣开发相关产品可留言讨论,我司在细胞质量一致性用在生产中,细胞规模培养,维持培养,产物上游研发有很多优势。
1) 浸没培养法,这是类器官培养模式中最为经典的方法。 该方法广泛用于各种肿瘤类器官的培养中,即孔板中包含类器官的胶体,凝固之后再加入无血清的培养基完全淹没。 这种培养方式被用于早期类器官模型的开发,成功培养出了
胃[7]、结直肠[8]、肾[9]、胰腺[10]、肝脏[11] 等类器官。
2) 气⁃液交互培养法,分内外皿两个部分,即内皿放置类器官,外皿放置培养基,且培养基的液面高度不高于类器官高度,这样既可以通过直接暴露于空气中从而促进气体交换,又可以通过底部的小孔吸收营养物质供类器官生长。 这种方式有利于保留免疫微环境中部分免疫细胞的成分,为研究肿瘤免疫微环境的调控机制及后续的癌症免疫治疗提供了良好的体外模型.
3)不同细胞共培养,这是一种在同一培养环境中直接或间接培养多种不同细胞类型的方法。 肿瘤微环境的重塑是目前各种模型研究中的重点和难点,共培养模式的提出一定程度上解决了这一难题,如肿瘤类器官与免疫细
胞、成纤维细胞共培养使得其更加真实地模拟体内肿瘤生态位,还原体内药物反应。 此外,还可根据不同的研究目的设计不同细胞和类器官组合的共培养体系,更加高效地进行研究。
Hans Clevers 团队通过患者来源的大细胞神经内分泌癌( large cell neuroendocrine carcinoma,LCNEC)类器官的建立确定前神经转录因子(ASCL1)是 LCNEC 对 BCL⁃2 抑制剂治疗反应肿瘤类器官用于抗肿瘤药物的高通量筛选
肿瘤类器官样本库的建立将成为新药临床前研究的有力工具类器官模型以其遗传特征稳定性、多克隆、反应供体病理生理特征以及可传代的特征受到广泛关注。 以肿瘤为例,消化系统和生殖系统建立了最多的生物样本库。 其中,结直肠癌、胰腺癌、乳腺癌、胶质瘤和膀胱癌的类器官培养技术最成熟。
接近体内病理生理状态,提高其模拟的精准性。 此外, 基于类器官理论, 新的模型如器官芯片[24]和 3D 3D生物打印[25]得到进一步发展,为建立更好的模型提供新的方案。
3D 培养-细胞嵌入到三维基质中,
肿瘤类器官生物样本库
移植瘤-痛点统计